Kognitív működések, magatartási és pszichés tünetek és életminőség demenciával járó neurodegeneratív és vaszkuláris kórképekben

Kognitív működések, magatartási és pszichés tünetek és életminőség demenciával járó neurodegeneratív és vaszkuláris kórképekben
Majer Réka
DEOEC Idegtudományi Doktori Iskola
DEOEC, Pszichiátria Tanszék
majer.reka@med.unideb.hu
Összefoglaló
A BPSD (behavioral and psychological syndromes in demencia=demenciában előforduló magatartási és pszichés tünetek) tünetek felismerése a mindennapi klinikai gyakorlatban látszólag egyszerű feladat. Ennek ellenére a BPSD-vel kapcsolatos farmakológiai vizsgálatok nehézségei a specifikus mérőskálák hiányára vezethetők vissza. Az egyes magatartási és pszichés jellegű tünetek vizsgálata és az ezek mögött álló patológiai elváltozások feltérképezése hiányos. A neuropszichológiai állapotfelmérés hozzájárulhat a prognosztikai előrejelzéshez, a gyógyszerek hatásmechanizmusának bővebb áttekintéséhez, illetve a személyre szabottabb és hatásosabb kezelési terv kidolgozásához. A BPSD nem egy betegségspecifikus klinikai szindróma, egy szub-szindrómáról van szó, amelyet igen heterogén tünetcsoportok alkotnak. A szindróma elnevezéséből kiindulva a BPSD tüneteket két fő csoportba sorolhatjuk. A viselkedési tünetek közé az agresszív magatartás, agitáció, kóborlás, gátlástalan viselkedés tartozik, a pszichés tünetekhez pedig a különböző hallucinátoros élmények, doxazmák, irritabilitás, alvás- és étvágyzavarok sorolhatók. Kutatásunkban megpróbáljuk feltérképezni, hogyan alakulnak a magatartási és pszichés tünetek a különböző demenciával járó neurodegeneratív és vaszkuláris kórképekben, és ezek milyen kapcsolatban állnak a kognitív funkciókkal és a betegek életminőségével.
Elméleti háttér, szakirodalmi bevezetés
A különböző eredetű demencia szindrómákat pszichológiai szempontból három fő tünetcsoport alkotja (kognitív, affektív és viselkedési), amelyeket többféleképpen csoportosíthatunk. A klinikai szempontok szerint legelfogadottabb csoportosítás kognitív, valamint viselkedési és pszichés tüneteket (behavioral and psychological symptoms of dementia, BPSD) különböztet meg. A demenciákhoz társuló kognitív tünetek (tanulási zavarok, rövid és hosszú távú memória deficit) megkülönböztetése, felismerése és súlyosságuk kvantifikálása a klinikus számára egyszerűbb feladat, mint a BPSD tünetek felismerése és kezelése. Talán ezért a különböző eredetű demencia szindrómákhoz társuló kognitív tünetek, idáig nagyobb figyelmet kaptak mind a klinikusok mind a kutatók részéről. A BPSD tünetek késői „felfedezéséhez” az is hozzájárulhatott, hogy ha a demencia szindrómára gondolunk mindenkinek elsősorban az emlékezés és figyelemzavar, az exekutív működések problémái, és a tanulási emlékezési deficit jut eszébe. A BPSD tünetek ezért sokáig a gerontopszichiátria „elhanyagolt területének” számítottak.
Maga a BPSD elnevezést 1996-ban az International Psychiatric Association (IPA) vezette be. Egy nem betegségspecifikus klinikai szindrómáról, szub-szindrómáról van szó, amelyet igen heterogén tünetcsoportok alkotnak. Kialakításában biológiai, pszichológiai és szociális tényezők interakcióit feltételezik. A költséghatékonysági, gazdasági mutatókat tekintve a BPSD tünetek jelentősége a kognitív tüneteket messze meghaladó.
A hazai orvosi gyakorlatban a BPSD elnevezéssel ritkán találkozhatunk. Helyette a klinikusok általában az agitáció, agresszív viselkedési zavar, nehéz vagy diszruptív viselkedés elnevezéseket használják, amelyek azonban szemantikailag nem felelnek meg a BPSD teljes tünettanának. Használatuk nem nevezhető korszerűnek és kívánatos lenne a kimondva kissé nehézkes demenciában előforduló viselkedési és pszichés zavarok, vagy röviden BPSD elnevezés alkalmazása a mindennapi klinikai gyakorlatban.
A BPSD tünetekkel kapcsolatosan nemcsak a diagnosztikus kritériumok szintjén van probléma. Alkalmazásukkal kapcsolatosan is számos kérdés merül fel. Nem tudjuk, hogy egyetlen szindrómának felelnek-e meg, vagy szubszindrómák rendszeréből állnak, és időbeli változékonyságuk törvényszerűségei sem tisztázottak. Kialakulásával kapcsolatos biológiai ismereteink nagymértékű heterogenitásra utalnak neurokémiai, neurobiológiai hátterük tekintetében is. Az sem tisztázott pontosan, hogy milyen formáik, és mikor igényelnek terápiás intervenciókat, esetleg farmakoterápiás megközelítést. A terápiás válasz különbségeit, hatékonyságát sem ismerjük az egyes demencia szindrómákhoz társuló BPSD tünetek kezelése tekintetében.
BPSD tünetek gyakorisága
A BPSD tünetek gyakoriságát tekintve általánosságban azt mondhatjuk, hogy a demencia szindróma prodromális állapotának tekintett enyhe kognitív zavarban már 50%-os gyakorisággal figyelhetők meg elsősorban az affektív klaszterhez tartozó BPSD tünetek. Kifejlődött demencia szindrómában a BPSD tünetek gyakorisága 20-90% között változik súlyosságtól függően. Intézeti körülmények között már 90%-os gyakoriságról is beszámoltak. Idősek otthonában pedig 20-50%-os előfordulási arányokat ismerünk. Az egyes tünetek közül az apathia előfordulása 45%, a depresszív tüneteké 44%, az agitáció gyakorisága pedig 40% körül valószínűsíthető a különböző vizsgálatok adatai szerint Fontos szempont, hogy az esetek 40%-ban nem egyetlen BPSD tünet van jelen, hanem igen gyakran akár ötnél több tünet is előfordulhat a demens betegeknél.
A BPSD tünetek jelentőségét az adja meg, hogy az idős, demens személyek intézeti elhelyezésének és mortalitásának legfontosabb meghatározói. Az intézeti elhelyezések eldöntésében kiemelkedő fontosságú a gondozói stressz, amely legtöbbször a BPSD tünetekre vezethető vissza. A BPSD tünetek mortalitási prediktor hatásával kapcsolatos felmérés szerint a tájékozódási problémák, elesések és az öltözködési nehézségek, mint a BPSD következményei, közel kétszeresére növelik a demens betegek mortalitási rizikóját.
Célkitűzés: A kutatási program célja
1. A különböző oki háttérrel rendelkező demens betegek kognitív funkcióinak vizsgálata, és ezek összehasonlítása az egyes körképekben a következő kérdésfeltevéssel:
Kimutatható-e demenciaspecifikus kongnitív tünetmintázat?
2. A különböző oki háttérrel rendelkező demens betegek magatartási és pszichés tüneteinek
felmérése, és ezek összehasonlítása a következő kérdésfeltevéssel:
Milyen arányban fordulnak elő az egyes BPSD tünetek a vizsgált betegcsoportokban?
Kimutatható-e demenciaspecifikus BPSD tünetmintázat?
3. A betegek életminőségének feltérképezése a következő kérdésfeltevéssel:
Van-e hatása a BPSD tüneteknek a betegek életminőségére?
4. A betegek utánkövetése és a kognitív funkciók illetve a magatartási és pszichés tünetek
változásának regisztrálása a következő kérdésfeltevéssel:
Milyen irányú és milyen jeleggű változás tapasztalható az egyes kórképekben a betegek
utánkövetése során?
5. Az életminőség, betegségteher és napi aktivitás monitorozása a következő kérdésfeltevéssel:
Milyen életminőségbeli változás tapasztalható a betegek utánkövetése során?
Módszerek
A betegkiválasztás szempontjai
A kutatásban a DEOEC Pszichiátriai Tanszékén, illetve DEOEC Neurológiai Klinikán gondozott különböző demenciában szenvedő betegek vesznek részt megfelelő szóbeli tájékoztatás és az azt követő beleegyező nyilatkozat aláírása után.
Kizárási kritériumok: mentális retardáció, pszichotikus zavarok, hangulatzavarok, depresszió diagnózis, palliatív gondozás, pszichoaktív szerhasználat a vizsgálatot megelőző két hétben, pszichoaktív szermegvonás szindróma
Létszám:
50 fő – Neurodegenerative demenciában szenvedő beteg
50 fő - Vaszkuláris demenciában szenvedő beteg
Tervezett vizsgálatok
A beválogatás során minden beteg klinikai interjún vesz részt, melynek célja a demográfiai adatok felvétele, a klinikai szempontból fontos információk összegyűjtése és a beteg diagnózisát alátámasztó SCID-I interjúk felvétele.
Szűrővizsgálatok
SCID-I (Structured Clinical Interview for DSM-IV Axis I): félig strukturált interjúmódszer, mely a DSM-IV I. tengelyhez tartozó fődiagnózisok felállítására szolgál, mely olyan tünetek módszeres feltárását teszi lehetővé, melyek egyébként elkerülnék a diagnózist felállító személy figyelmét. Hat, viszonylag önálló modulra oszlik, melyeken általában sorban kell végighaladni, de a sorrend változtatható is és egyes modulok kihagyhatók. Az interjú időtartama: 45-90 perc.
Ischaemiás pontozó skála: Szinte egyedülálló, de nagyon hasznos módszer a demencia oki
differenciáldiagnózisának feltárására. Az Alzheimer típusú és a vaszkuláris demencia elkülönítésére alkalmas eszköz. Validitását neuropatológiai vizsgálatok is igazolták. Egyfajta strukturált interjúnak is felfogható. A BPSD tünetek feltárása mellett nagyon hasznos, ha képet kapunk a demencia okát illetően, mivel behatárolhatjuk a várható magatartási és pszichés tüneteket.
Rövid Geriátriai Depressziós Skála: Az időskori depresszió sajátos vonásai, és gyakorisága miatt a depresszió esetén általánosságban használt skálák (pl. Hamilton, Back) demencia esetében nem alkalmazhatóak, viszont nagyon fontos a depresszió, a depressziós pszeudodemencia és a demenciával járó hangulatzavar differenciálása. A Rövid Geriátriai Depresszióskála egy egyszerű, gyors, könnyen használható módszer az időskori depresszió diagnosztizálására.
Kognitív funkciók mérése
MMSE+C: Mini Mental State a nemzetközi gyakorlatban legelterjedtebb gyors kognitív
szűrővizsgálat. Hátránya, hogy a terápia hatékonyságát nem tudja mérni és nem ad lehetőséget a finom eltérések regisztrálására. Az MMMS+C az Mini Mentál teszthez csatolt kortikális teszt segítségével az egyes lebenyek károsodásáról kaphatunk képet, több információt ad a beteg állapotáról, használható az eredményesség mérésére.
Órarajz: A tervezés, konstuktivitás és motoros kivitelezés mérésére használt gyors, de informative rajzteszt, melynek kvantitatív ás kvalitatív elemézése értékes információkat nyújt a beteg állapotáról.
ADAS-Cog: Az egyik leggyakrabban használt kognitív mérőskála az Alzheimerrel-kapcsolatos klinikai diagnosztikus munka és kutatás során. 12 altesztből épül fel, melyek alapján megbízhatóan alkalmazható a betegek diagnosztikája, állapotmeghatározása és nyomonkövetése során. Bár a tesztet elsősorban az Alzhemerben használják, a próbák általánosíthatósága miatt széles körben elterjedt más oki hátterű demenciákban is.
BPSD tünetek mérése
Reisberg-féle BEHAVE-AD skála: A nemzetközi gyakorlatban a magatartási és pszichés zavarok feltárására a legelterjedtebb a BEHAVE-AD skála. Felvétele a kb. 20-25 percet vesz igénybe. A kérdések arra irányulnak, hogy az elmúlt két hetes időszakban tapasztalta-e a beteg a különböző kórtüneteket, és ha igen, milyen mértékben.
Neuro-pszichiátriai mérőskála (Neuropsychiatric Inventory, NPI). Az NPI tizenkét
kérdéscsoportból áll, melyet a gondozóval történő interjú alapján tölt ki a kezelőorvos. Klinikai farmakológiai vizsgálatokban gyakran használják a farmakoterápia
hatékonyságának megítélése céljából. A felvétele kb. 10-15 percet vesz igénybe.12 tünetet vizsgál, gyakoriságot és súlyosságot is figyelembe véve.
Behaviorial Syndromes Scale for Dementia (BSSD) Devanand és munkatársai által kidolgozott skála a viselkedéses tünetek vizsgálatára. A skála elsősorban a bentfekvő betegek és a szociális otthonok lakóinál használható jól. Egyhetes megfigyelési időszak alapján a hozzátartozó vagy az ápoló értékel egy 0-tól 6-ig terjedő skálán.
A három mérőskála közül adott beteg állapota dönti el, hogy melyiket lehet használni, de mivel a skálá hasonló itemeket mérnek, lehetőség van az összahasonlításra.
Életminőség, betegségteher, napi aktivitás mérése
WHO Jól-lét Index (WBI-5) A Jól-lét skála az egyik leggyakrabban használt mérőeszköz, amelyet a pszichológiai jól-lét önértékelésén alapuló mérésre használnak. Az index validálása a Hungarostudy 2002 országos lakossági egészségfelmérés alapján készült.
Betegségteher Index (Illness Intrusiveness Rating Scale, IIRS). A betegségteher a krónikus betegek esetében az életminőség egyik meghatározó tényezője. Az általunk használt betegségteher mérő kérdőív a Devins és munkatársai által 1997-ben publikált Illness Intrusiveness Rating Scale. Ez egy általános mérőeszköz, mely azt méri, hogy egy krónikus betegség vagy annak kezelése milyen hatást gyakorol a beteg által megélt életminőségre.
Napi Aktivitás Károsodása (Activity of Daily Living/ADL) A Tekin és munkatársai által
kidolgozoztt Napi Aktivitás Károsodása skála azt vizsgálja, hogy a beteg bizonyos mindennapi tevékenységeket mennyire tud önállóan elvégezni. Minél kevesebb pontot ér el a beteg, annál kevésbé funkcionál. A Napi Aktivitás Károsodása Skála nagyon jól használható utánkövetésre, állapotromlás követésére.
Statisztikai módszerek: Az adatok elemzése az R statisztikai program és az Excel segítségével történik.
Adatkezelési módszerek: A változók elemzése anonimizált formában, kódok segítségével történik.
Eredmények
A kutatásban eddig 36 fő került bele, átlagéletkoruk 74 év. Ebből 10 férfi, átlagéletkor 73 év, 26 nő, átlagéletkoruk 75 év. A betegek közül 22 fő házas, 4 elvált, 10 özvegy. Átlagosan 2 gyerekük van. 19 fő a házastársával él, 3 fő párkapcsolatban, 5 fő a gyerekével él, 3 fő az unokájával és 6 fő egyedül él. a legtöbb beteg iskolai végzettsége érettségi (13 fő) vagy 7-12 osztály érettségi nélkül (13 fő), illetve 6 fő technikum, 2 fő főiskola, 2 fő 6 osztály. A betegek mind járóbetegként jelentek meg, hozzátartozójukkal. Gondozásban nem ált egy beteg sem, illetve egyik sem élt otthonban. 32 fő nyugdíjas volt, 4 fő pedig rokkantnyugdíjas.
Átlagosan 5 éve kezdődött a betegségük. A legtöbb beteg G.3090=Alzheimer kór k.m.n, vagy F03=Nem maghatározott demencia diagnózissal szerepelt a medsol rendszerben. Mivel nem voltak egyértelműek a diagnózisok, a betegeket az általam felvett Hachinski Skála értéke alapján soroltam be három csoportba: 0-4 pont=neurodegeneratív demencia, 5-6 pont=kevert demencia, 7 pont vagy felette=vaszkuláris demencia. Az eredmények alapján 18 beteg esett a degeneratív csoportba, 11 fő kevert és 7 fő vaszkuláris demens.
Ezek után megvizsgáltam, hogy az általam felvett kognitív funkciót, magatartási és pszichés tüneteket (Behavioral and Psychological Symptoms of Dementia=BPSD ) és életminőséget mérő kérdőívek hogyan alakulnak a teljes mintán, illetve az egyes csoportokban, van-e szignifikáns eltérés az egyes csoportok közt, illetve vannak-e együtt járások bizonyos mutatók közt.
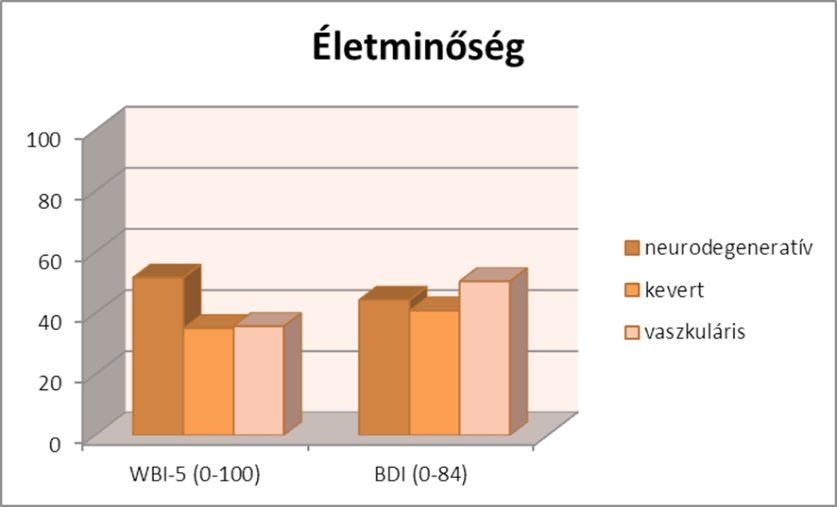
A teljes minta életminősége a következőképpen alakult: A Jól-lét (Well Being Index=WBI-5) értéke átlagosan 43%-os, ami átlag alatti, mivel a magasabb pontszám jelent jobb életminőséget. Ehhez egy átlag 44 pontos betegségteher társul, ami szintén elmarad az egészséges átlagtól. Ez esetben a magasabb pontszám jelent nagyobb terhet.
A három csoport összehasonlításában az látható, hogy az átlagok különböznek, de nincs szignifikáns eltérés a három csoportban a jól-lét tekintetében (p=0,07), de az átlagok összehasonlításával úgy tűnik a neurodegeneratív demens csoportban a legjobb az életminőség, a másik kettőben pedig közel azonos. A betegségteher index esetében hasonló minta mutatkozik, szintén nincs szignifikáns eltérés (p=0,23).
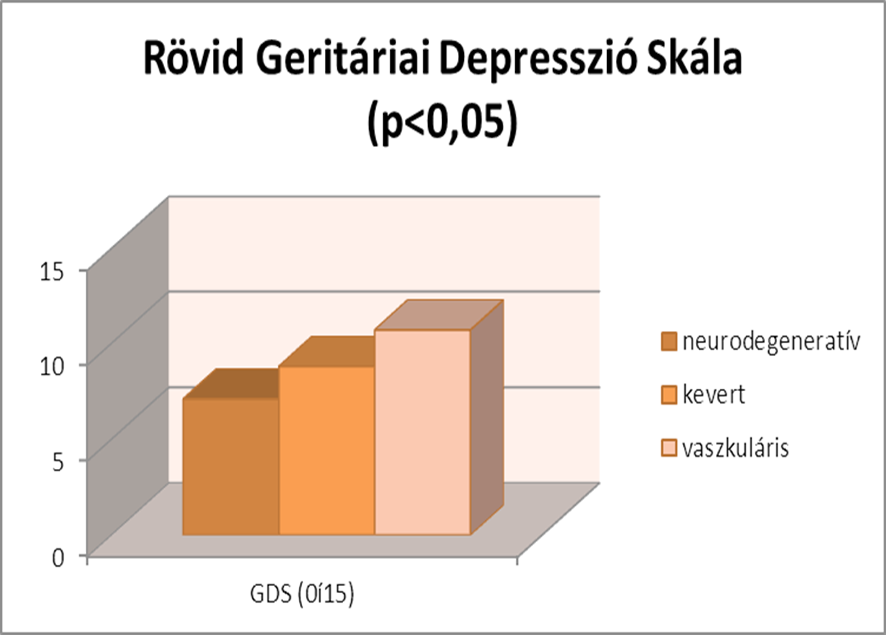
Demens betegek esetében igen jelentős az időskori depresszió megjelenésének gyakorisága. Ezt a minta is alátámasztja. A Geriátriai Depresszió Skála átlagértéke 8, ami magas pontszámnak számít, mivel 5 pont alatt tekintjük egészségesnek. A három csoport közt gyenge szignifikáns különbség áll fent (p=0,04). A vaszkuláris demensek érték el a legmagasabb pontszámokat, míg a neurodegeneratív csoport a legalacsonyabbakat. A vaszkuláris csoport magasabb pontszámát alátámasztja, hogy a vaszkuláris betegségekben (szívinfarktus, stroke) magasabb a depresszió kialakulásának valószínűsége.
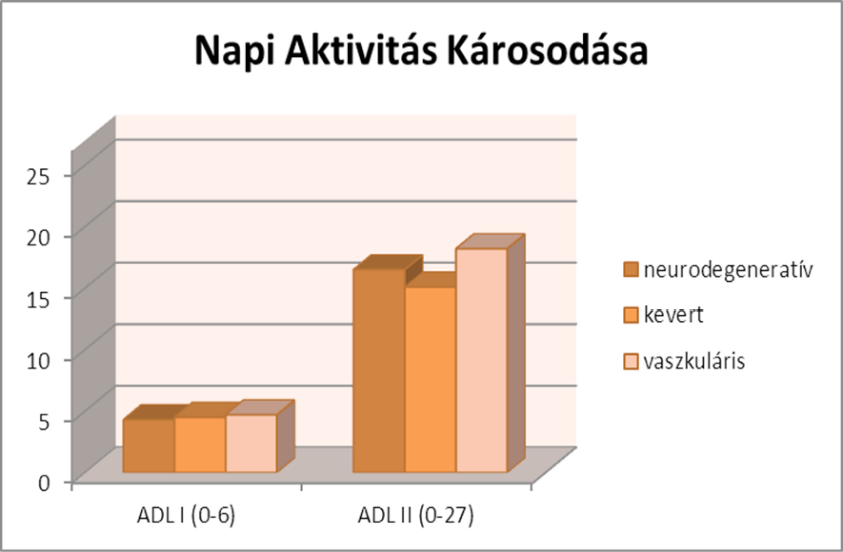
A napi aktivitás károsodása átlagértéke 4 pont, eszközhasználat tekintetében 16 pont. A csoportok közt nincs szignifikáns különbség (ADLI p=0,8, ADLII p=0,5).
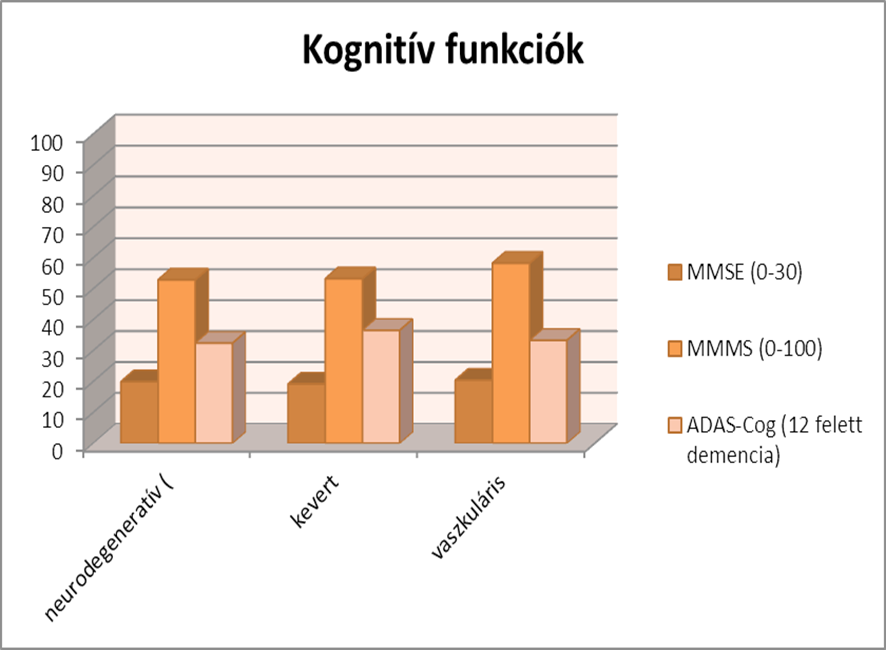
A kognitív funkciók a következőképen alakultak a mintában: A MMSE eredménye 19 pont az egész mintán, ami alapján a minta közepesen súlyos demens betegekől áll. Ezt támasztja alá, hogy a betegek közt, nincs intézetben elhelyezett beteg. A három csoportban nincs szignifikáns eltérés (p=0,85). A MMMS átlaga 54 pont, a csoportok közt nincs szignifikáns eltérés (p=0,77). Az ADAS átlaga 33 pont a csoportok közt itt sincs szignifikáns eltérés (p=0,76). Az első hipotézisem, miszerint kimutatható demenciaspecifikus kognitív tünetmintázat egyelőre nem igazolódott be, mivel a kis elemszám miatt nincsenek szignifikáns eltérések a kognitív funkciók tekintetében.
A magatartási és pszichés tünetek alakulása
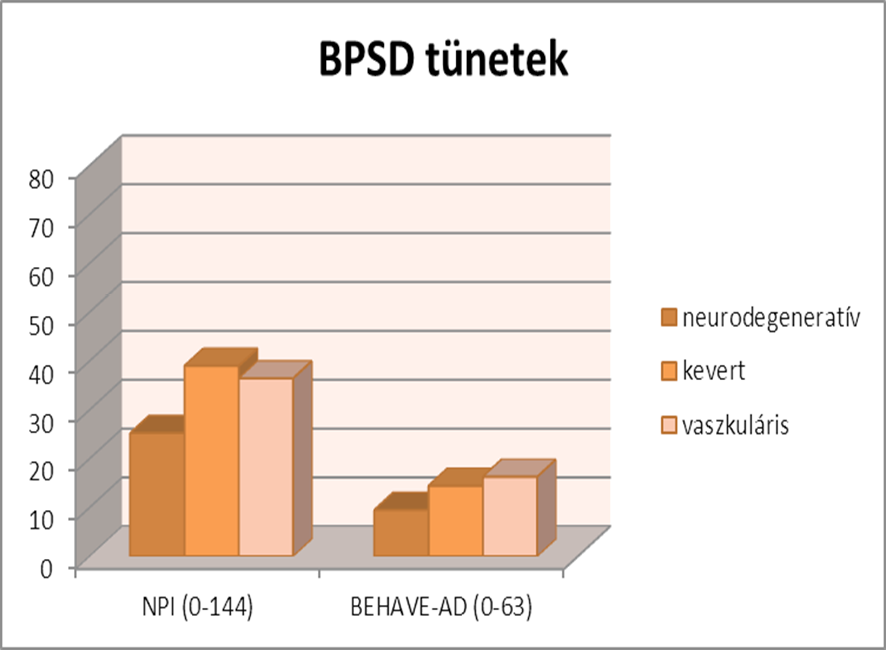
Az NPI átlagértéke 36 pont. A három csoportban nincs szignifikáns különbség (p=0,1). A BEHAVE-AD átlagértéke 12 pont, a csoportok közt szintén nincs szignifikáns különbség (p=0,06).
Az BPSD tünetek részletesebb elemzése alapján az alábbi következtetések vonhatóak le: Az NPI 12 tünete közül a gyakoriság tekintetében a depressziót jelölte be a legtöbb beteg, amit az agitáció, kóros motoros magatartás, szorongás, izgatottság, apátia követ. Ha a tünethez rendelt pontszámot is figyelembe vesszük a leggyakrabban előforduló tünet a kóros motoros magatartás, éjszakai kórtünetek, evés-étvágy változása, agitáció, hallucináció, szorongás. Habár többen jelezték a depresszió, agitáció előfordulását ezek kevésbé gyakran fordulnak elő a mindennapokban, mint a kevesebb beteg esetében jelzett éjszakai kórtünetek vagy hallucináció, viszont ezek megjelenése a beteg egész napjára hatással van. A tünetek súlyosságát tekintve úgy tűnik az agitáció a legsúlyosabb tünet, ami a hallucináció és depresszió követ. Az hogy egy adott tünet mennyire zavaró a hozzátartozó számára a következő képet mutatja: a leginkább nehezen viselhető a hallucináció és a kóros motoros magatartás, ezt követi a depresszió majd az agitáció és apátia. Úgy tűnik, az hogy egy tünet előfordulási gyakorisága kevésbé befolyásolja a hozzátartozó terhét, mint az adott tünet súlyossága.
A BEHAVE-AD átlagpontszáma 12 a teljes mintán. Ha ez egyes tüneteket külön értékeljük, úgy tűnik a legtöbb beteg esetében az inadekvát tevékenység, és a céltalan aktivitás került megjelölésre, és csak azt követték az affektív tünetek. Ha a súlyosság tekintetében nézzük a legmagasabb pontszámot az elhagyatás téveszméje, az egyéb hallucinációk és az inadekvát tevékenységek kapták, vagyis az NPI eredményekhez hasonlóan egyes tünetek bár kevesebb betegnél jelennek meg, ha megjelennek, jelentősebben rontják az állapotot, mint azok a tünetek, melyek szinte minden betegnél előfordulnak, de kevésbé súlyos formában.
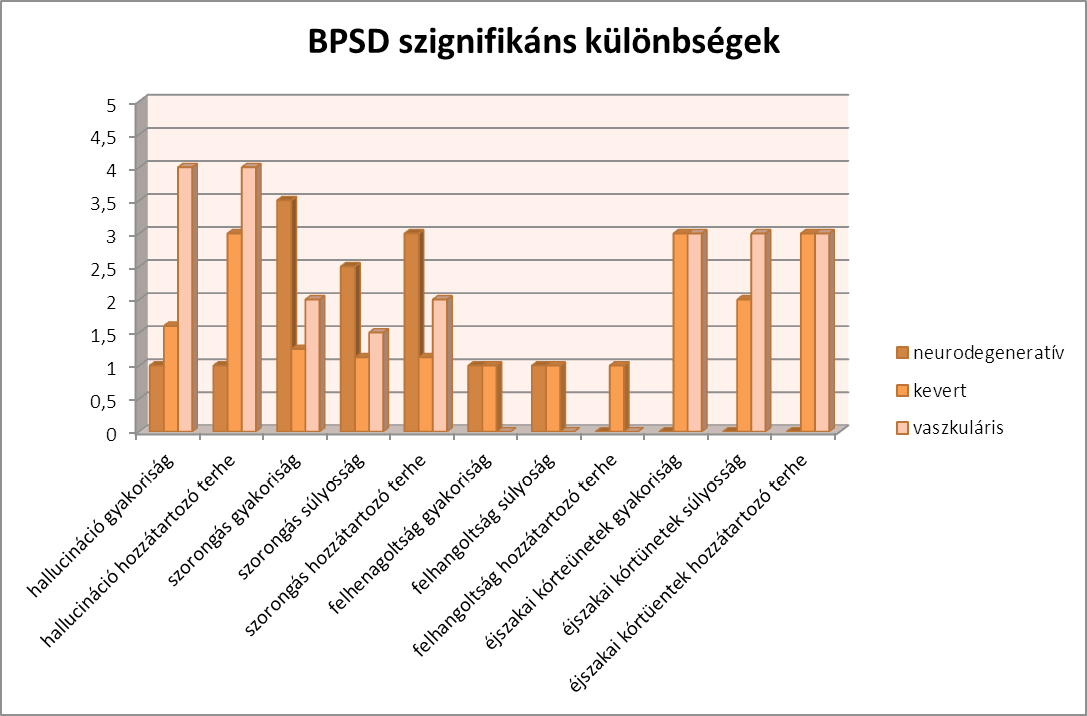
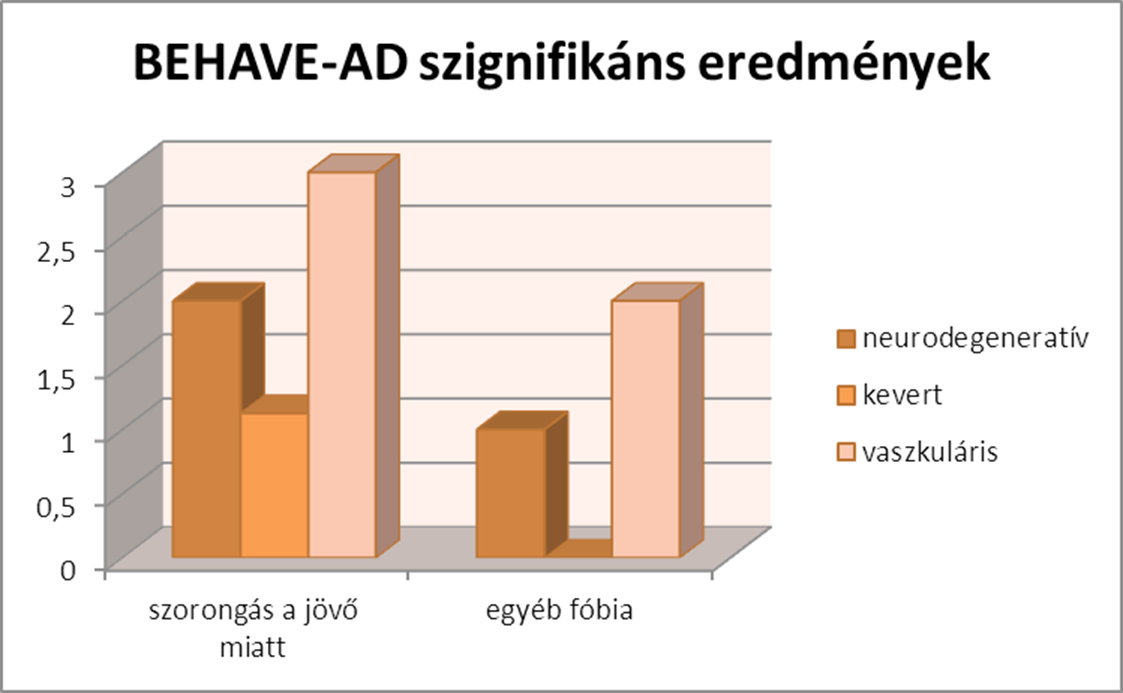
Azzal kapcsolatban, hogy ki lehet-e a mutatni demenciaspecifikus tünetmintázatot, a következő eredmények születtek, a kis elemszám mellett. Az NPI eredményeken szignifikáns (p <0,05) különbség mutatkozik a hallucináció, szorongás, felhangoltság és éjszakai kórtünetek tekintetében, a gyakoriság, súlyosság és hozzátartozó terhe mutatókban. A BEHAVE-AD eredményekben szintén szignifikáns (p <0,05) különbség mutatkozott a szorongás az eljövendő események miatt, és az egyéb fóbia mutatókban.
A hallucináció szignifikánsan magasabb a vaszkuláris csoportban, míg a szorongás a neurodegeneratív csoportban magasabb. A felhangoltság a vaszkuláris csoportban nem jelent meg, az éjszakai kórtünetek pedig a neurodegeneratív csoportban nem jelentek meg. A szorongás súlyossága a neurodegeneratív csoportban szignifikánsan magasabb, míg az éjszakai kórtünetek nem jelentek meg ebben a csoportban, a vaszkuláris csoportban pedig súlyosabbak, a felhangoltság pedig hasonló a neurodegeneratív csoportban és a kevert csoportban, míg a vaszkulárisok közt nem jelent meg. A hozzátartozó terhe szignifikánsan magasabb a vaszkuláris csoportban hallucináció esetében, míg szorongás esetében a neurodegeneratív csoportban magasabb a hozzátartozó terhe. A felhangoltság csak a kevert csoportban jelent terhet a hozzátartozó számára, míg az éjszakai kórtünetek nem jelentek meg a neurodegeneratív csoportban.
A BEHAVE-AD eredményeben szignifikáns eredmény mutatkozott a jövő miatti szorongás mutatóban, miszerint a vaszkuláris csoportban a legmagasabb a jövő miatti szorongás, míg az egyéb fóbia mutató szignifikánsan gyakrabban jelent meg a vaszkuláris csoportban.
Végül megvizsgáltam, hogy az egyes mutatók közt látszik-e valamilyen irányú együtt járás, az eredmények korrelálnak-e egymással. Az életkornak a kognitív funkciókra van hatása, de a BPSD tünetek esetében gyenge kapcsolat mutatható ki. Erős pozitív korrelációt találtam az NPI és a BEHAVE-AD eredmények közt (korrelációs együttható=KE=0,76), vagyis az egyik tesztben magas pontszámot elérők a másikban is magasabb értéket érnek el.
A BPSD tünetek hatását vizsgálva az életminőségre és betegségteherre a következő eredmények születtek: A jól-lét az NPI eredményekkel közepesen erős negatív kapcsolatban van (-0,61), mivel a jobb életminőséggel kevesebb magatartási és pszichés tünet jár együtt, ez a BEHAVE-AD esetében hasonlóan alakul (-0,54). A betegségteherrel kapcsolatban szintén hasonló összefüggés látható, több magatartási és pszichés tünet előfordulása rosszabb betegségteher index értéket eredményez. BDI-NPI=0,61, BDI-BEHAVE-AD=0,65.
Egy esetben volt még erős korreláció, a mindennapi eszközhasználat és a kognitív funkciók közt, vagyis rosszabb kognitív funkcióval rosszabb eszközhasználat és a napi aktivitás súlyosabb károsodása jár együtt (ADL II-MMSE KE=0,68, ADL II-MMMS KE=0,7, ADL II-ADAS KE=-0,76).
Összegzés
A kutatástól azt várjuk, hogy pontos képet kapunk azzal kapcsolatban, hogy az egyes demenciával járó kórképekben, milyen magatartási és pszichés tünetek előfordulása valószínűsíthető, milyen gyakorisággal, és ezek hogyan befolyásolják a betegek életminőségét és a mindennapi aktivitásukat. Emellett terveink szerint azt is látni fogjuk, hogy a kognitív funkciók progrediálása mellett hogyan alakulnak a magatartási és pszichés tünetek.
Mivel a kutatás még kezdeti fázisban tart, egyelőre nem lehet pontos eredményekről beszámolni, csak előzetes eredményeket látunk. A kis elemszám miatt nincsenek szignifikáns különbségek, de a szakirodalmi háttér alapján érdemes folytatni a kutatást, minél nagyobb elemszám mellett. Annak ellenére, hogy a felvetett hipotéziseink nem teljesültek, az már látszik, hogy a magatartási és pszichés tünetek, melyek a kutatásunk középpontjában állnak, igen jelentős mértékben megjelennek a betegek mindennapjaiban, erősen hozzájárulva az életminőségük csökkenésére és a hozzátartozó terhének növekedésére. A demenciában megjelenő magatartási és pszichés tünetek saját mintánkban igen jelentős gyakorisággal jelentek meg, minden beteg beszámolt valamilyen tünet megjelenéséről, a legtöbben több tünetről is, ami alátámasztja, hogy szükséges foglalkozni a témával. A magatartási és pszichés tünetek jelentős mértékben meghatározzák mind a beteg életminőségét, mind a hozzátartozó terhét. Úgy tűnik, hogy van különbség a magatartási és pszichés tünetek megjelenésének gyakoriságában és súlyosságában az egyes demencia szindrómák esetében, mely alátámasztja kezdeti hipotézisünket, miszerint kimutatható demenciaspecifikus tünetmintázat.
Irodalomjegyzék
Barber R, Gholkar A, Scheltens P, Ballard C, McKeith IG, O’Brien JT. Medial temporal lobe atrophy on MRI in dementia with Lewy bodies. Neurology 1999; 52:1153-1158.
Bassiony MM, Steinberg MS, Warren A, Rosenblatt A, Baker AS, Lyketsos CG. Delusions and hallucinations in Alzheimer’s disease: prevalence and clinical correlates. Int J Geriatr Psychiatry 2000; 15:99-107.
Cummings J. L. et al. The Neuropsychiatric Inventory Comprehensive assessment of psychopathology in dementia. Neurology December 1, 1994 vol. 44 no. Devanand DP et al.: Behaviorial syndromes in Alzheimer’s disease. Int. Psychogeriat 1992, 4:161
Farber NB, Rubin EH, Newcomer JW, Kinscherf DA, Miller JP, Morris JC, Olney JW, McKeel DW Jr. Increased neocortical neurofibrillary tangle den sity in subjects with Alzheimer disease and psychosis. Arch Gen Psychiatry 2000; 57:1165-1173.
Finkel SI, Burns A, Cohen G. Behavioral and psychological symptoms of dementia (BPSD): a clinical and research update, overwiew. Int Psychogeriatr 2000; 12:13-18
Frisoni GB, Rozzini L, Gozzetti A, Binetti G, Zanetti O, Bianchetti A, Trabucchi M, Cummings JL. Behavioral syndromes in Alzheimer’s disease: description and correlates. Dement Geriatr Cogn Disord 1999; 10: 130-138.
Geerlings MI, Schoevers RA, Beekman AT, Jonker C, Deeg DJ, Schmand B, Adèr HJ, Bouter LM, Van Tilburg W. Depression and risk of cognitive decline and Alzheimer’s disease. Results of two prospective community-based studies in The Netherlands. Br J Psychiatry 2000; 176:568-575. In Kálmán J., Kálmán S., Pákáski M. Demenciákhoz társuló visekedési és pszichés zavarok felismerése és kezelése antipszichotikumokkal: A CATIE-D vizsgálat tanulságai. Neuropsychopharmacologia Hungarica, 2008; X/4. 233-249.
Hatcinski VC. Vascular Dementia: a radical redefinition. Dementia 1994. 5: 130
Kálmán J., Kálmán S., Pákáski M. Demenciákhoz társuló visekedési és pszichés zavarok felismerése és kezelése antipszichotikumokkal: A CATIE-D vizsgálat tanulságai. Neuropsychopharmacologia Hungarica, 2008; X/4. 233-249.
McKeith I, Cummings J. Behavioural changes and psychological symptoms in dementia disorders. Lancet Neurol 2005; 4:735-742.
Nagata K., Yokoyama E., Yamazaki T., Takano D., Maeda T., Takahashi S., Terayama Y. Effects of yokukansan on behavioral and psychological symptoms of vascular dementia: An open-label trial. Phytomedicine, Volume 19, Issue 6, 15 April 2012, Pages 524-528
Novák M., Szeifert L., Mucsi Z.: Measuring quality of life for chronically illness: The Illness Intrusiveness Rating Scale [Krónikus betegek életminőségének mérése: a Betegségteher Index]. In: Kopp M., Kovács M.: [A magyar népesség életminősége az ezredfordulón]. 2006. Semmelweis Kiadó, Budapest, 406-411.
Pákáski M., Drótos G., Janka Z., Kálmán J. 2012. Az Alzheimer’s Disease Assessment Scale kognitív alskála Magyar verziójának validálása. Orvosi Hetilap, 153,12: 461-466.
Reisberg B. et al.: Behaviorial symptoms in Alzheimer’s disease: Phenomenology and treatment J Clin Psychiat 1987, 48:9.
Robert PH, Verhey FRJ, Byrne EJ, Hurt C, De Deyn PP, Nobili F, Riello R, Rodriguez G, Frisoni GB, Tsolaki M, Kyriazopoulou N, Bullock R, Burns A, Vellas B. Grouping for behavioral and psychological symptoms in dementia: clinical and biological aspects. Consensus paper of the European Alzheimer disease consortium. Eur Psychiatry 2005; 20:490-496.
Ropacki SA, Jeste DV. Epidemiology of and Risk Factors for Psychosis of Alzheimer’s Disease: A Review of 55 Studies Published From 1990 to 2003. Am J Psychiatry 2005; 162: 2022- 2030.
Susánszky É., Konkoly Thege B., Stauder A., Kopp M.: The WHO’s well-being questionnaire short-form (WBI-5) validation of the Hungarian version of the Hungarostady 2002 national population health survey [A WHO Jól-lét kérdőív rövidített (WBI-5) magyar változatának validálása a 2002 országos lakossági egészségfelmérés alapján]. 2006. Mentálhigiéné és Pszichoszomatika, 7(3), 247-255.
Szádóczky E. Rózsa S., Unoka Zs., 2006. Strukturált klinikai interjú a DSM-IV I-es tengely zavarainak felmérésére (SCID-I). OS Hungary Kft.
Tariska P. (szerk.) Neuropszichiátria. Medicina, Budapest, 2000.b
Tariska P. 2002. Kortünet vagy kórtünet? Mentális zavarok az időskorban. Medicina Kiadó, Budapest.
Tariska P. Alzheimer-kór. Golden Book Kiadó, Budapest, 2000.a
Tekin S, Mega MS, Masterman DM, Chow T, Garakian J, Vinters HV, Cummings JL. Orbitofrontal and anterior cingulate cortex neurofibrillary tangle burden is associated with agitation in Alzheimer disease. Ann Neurol 2001; 49:355-261
Tekin, Sibel M.D.; Fairbanks, Lynn A. Ph.D.; O’Connor, Susan R.N.; Rosenberg, Susan R.N.; Cummings, Jeffrey L. M.D. Activities of Daily Living in Alzheimer’s Disease: Neuropsychiatric, Cognitive, and Medical Illness Influences. American Journal of Geriatric Psychiatry: Winter 2001 - Volume 9 - Issue 1 - p 81-86
Valikovics A. 2007. A Vinoceptin agyi véráramlásra és kognitív funkciókra gyakorolt hatásának vizsgálata. Ideggyógyászati Szemle, 2007; 60 (7-8):301-310.
Verhey F, Aalten P, de Vugt ME. Incidence, prevalence and persistence of behavioral disorders in dementia. Int Psychogeriatr 2003; 15(Suppl 2):78
Yeh Y., Ouyang W-C. Mood stabilizers for the treatment of behavioral and psychological symptoms of dementia: An update review Review Article. The Kaohsiung Journal of Medical Sciences, Volume 28, Issue 4, April 2012, Pages 185-193